类器官一站式解决方案
类器官培养基试剂盒、类器官构建服务、类器官技术平台搭建服务
类器官药敏检测服务、CRO药效、安全性评估服务、类器官基因编辑服务等
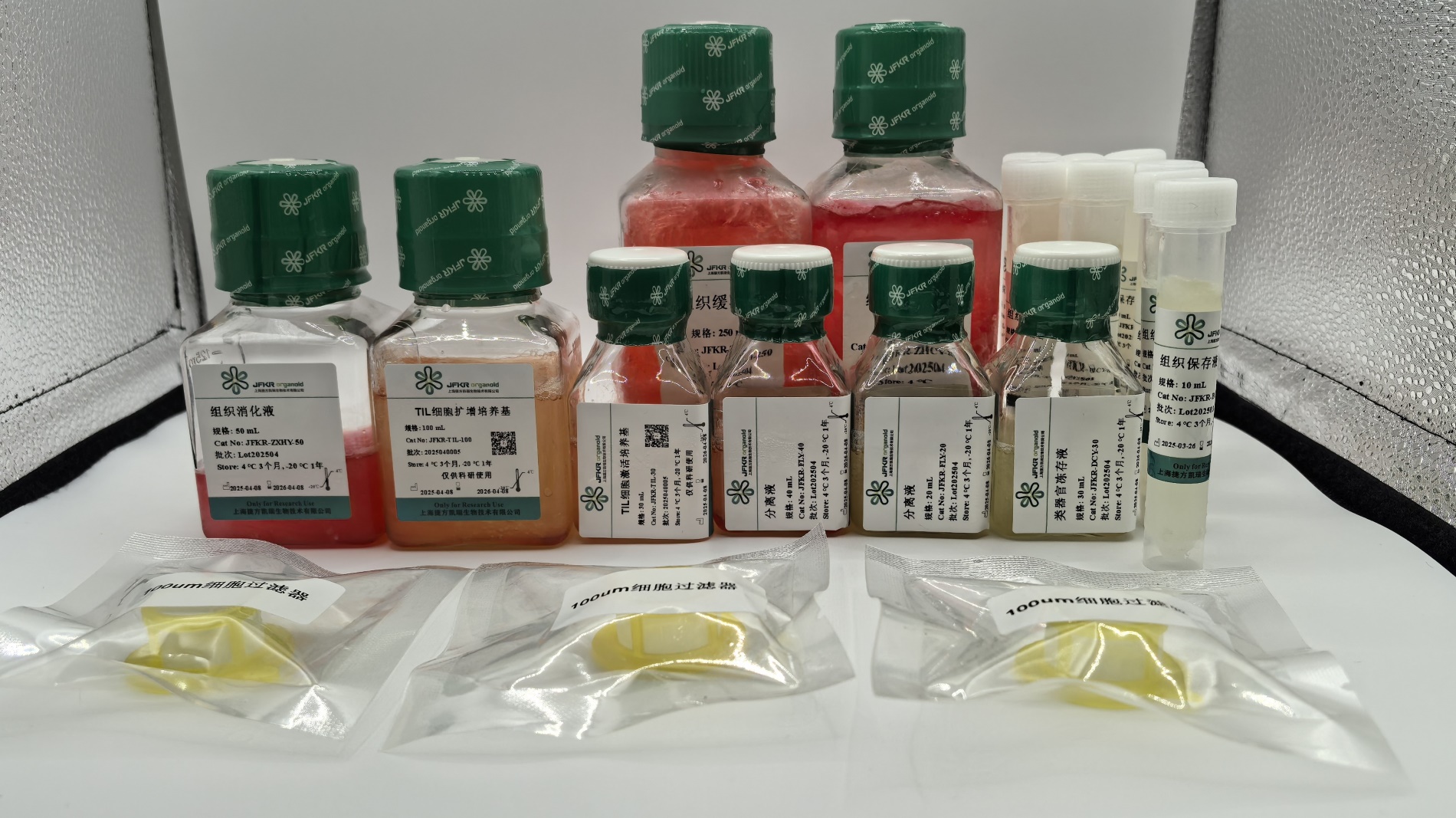
货号:JFKR-TIL-100/JFKR-TIL-500
|
|
产品组成 |
规格 |
储存条件及周期 |
|
1 |
TIL细胞扩增培养基A |
100 mL |
4 ℃, 3 months或者 -20 ℃,1 year |
|
2 |
TIL细胞激活培养基B |
30 mL |
4/-20 ℃,2 year |
|
3 |
组织消化液C |
50 mL |
4/-20 ℃,1 year |
|
4 |
分离液D |
20 mL |
常温 |
|
5 |
分离液E |
40 mL |
常温 |
|
6 |
细胞滤筛 |
100μm |
常温 |
|
7 |
组织缓冲液 F |
2x250 mL |
4/-20 ℃,2 year |
|
8 |
组织保存液G |
5X8ml |
4/-20 ℃,1 year |
|
9 |
冻存液H |
30ml |
4/-20 ℃,1 year |
1. TIL细胞扩增培养基A 、TIL细胞激活培养基B在4 ℃可保存3个月,收到货后4 ℃保存,建议1个月内使用完毕,长期不用建议放于-20 ℃储存,避免反复冻融超过2次。
2.组织保存液G、组织消化液C内含有维持细胞活性营养成分,为了保持试剂营养成分的活性,长期不用建议放于-20 ℃储存,避免反复冻融超过2次。
需提前准备缓冲液F(4 ℃预冷)、组织保存液G、取样管、组织运输箱、冰袋。
组织的取样与运输是TIL提取成功的第一个环节也是最容易忽视的环节,若组织前期保存不当会导致细胞活性差、污染、正常细胞少等问题,降低TIL提取成功率。
组织应在离体的30 min内放入组织保存液G,缓冲液F清洗3-5次,将组织表面血液冲洗干净,放入组织保存液G中,取样管于4 ℃低温保存运输(72 h内)。
需提前准备缓冲液F(4 ℃)、组织消化液C(37 ℃)、分离液 D、分离液E、TIL扩增培养基A、TIL激活培养基B(室温或37 ℃)、镊子(10㎝)、尖头眼科手术剪/手术刀片、一次性60 mm培养皿、1.5 mL/15 mL/50 mL离心管、100㎛细胞滤网、3 mL巴氏吸管/1000 μL移液枪、24孔细胞培养板、金属冰盒。
取材后的组织建议在 2 – 8 ℃条件下保存运输,快速转运至洁净实验室进行TIL提取实验流程,组织拍照并登记详细信息。
取样管消毒后,在超净台中将组织取出来,放入培养皿中,加入缓冲液 F,用3 mL巴氏吸管或1000 μL移液枪吹打清洗,重复清洗操作三次及以上。
用眼科剪或手术刀片去除组织杂质,镊子转移至1.5 mL EP管中,用眼科剪进一步将组织机械解离成体积约为 1~3 mm3的组织块,转移至15 mL EP管中,加入8 mL组织消化液37 ℃震荡消化60min。消化过程每20min显微镜下观察组织消化情况,取少量消化液在显微镜下观察,观察到较多的单个细胞后进行下一步操作。
加入3倍体积的缓冲液F终止消化,消化完成组织通过100 μm孔径的细胞筛网过滤,收集滤液。
按顺序依次添加TIL分离液D 2ml,分离液E 4ml于15ml离心管,再沿离心管壁轻轻加入组织滤液6ml,2000转离心20min,收集D分离液界面上的细胞,该层富含TIL 细胞的悬液,离心1500转10min。分离液E的界面层主要为肿瘤细胞。再用缓冲液F清洗TIL细胞洗2 次,以除去细胞分离液,得到TIL细胞沉淀。
可选择合适的TIL细胞量进行程序降温冻存。
需提前准备缓冲液F(4 ℃)、TIL扩增培养基A,TIL激活培养基B(室温或37 ℃)、15 mL/离心管、3ml巴氏吸管/1000 μL移液枪、24孔细胞培养板。
将分离好的TIL细胞计数。
TIL细胞激活培养基B重悬TIL细胞(浓度200000 cell/ml),每孔添加1.5mlTIL细胞激活培养基B,连续激活48h。
激活后的TIL细胞,缓慢沿细胞板侧壁吸取TIL细胞激活培养基B(注意:不要吸取细胞)
每孔添加1.5mlTIL细胞扩增培养基A连续扩增培养。
在连续培养第4天(此时可观察到T细胞明显成团),缓慢沿细胞板侧壁吸取TIL细胞扩增培养基A,添加新鲜TIL细胞扩增培养基A,连续培养5天(此时可观察到大量T细胞明显成团悬浮于培养基内)。
可进行流式分选鉴定。
缓冲液F、TIL细胞扩增培养基A、 TI细胞L扩增培养基B、孔细胞培养板、15mL离心管、水浴锅、3mL巴氏吸管/移液枪。
取15ml离心管,添加8ml缓冲液F待用
从低温环境中取出冻存的细胞,快速置于37 ℃水浴锅中融解,水浴融解过程中,需轻轻摇动冻存管,以确保冻存液在短时间内完全融解。将解冻后的T细胞快速转移至15 mL离心管,使用移液枪轻柔吹打6-8次,1000转离心5 min弃上清。将T细胞沉淀计数,添加合适的 TIL细胞激活培养基B混匀(浓度500000 cell/ml),每孔添加1.5ml混合液于24孔细胞培养板内观察培养48h。
激活后的TIL细胞,缓慢沿细胞板侧壁吸取TIL细胞激活培养基B(注意:不要吸取细胞)
每孔添加1.5mlTIL细胞扩增培养基A连续扩增培养。
在连续培养第4天(此时可观察到T细胞明显成团),缓慢沿细胞板侧壁吸取TIL细胞扩增培养基A,添加新鲜TIL细胞激扩增培养基A,连续培养5天(此时可观察到大量T细胞明显成团悬浮于培养基内)。
可进行流式分选鉴定
将悬浮于培养基内的T细胞团收集于15ml离心管,1000转离心5min,细胞计数(浓度为200000 cell/ml)。TIL细胞扩增培养基A重新接种24孔细胞培养板。根据接种密度不同48-72h可完成扩增。
传代缓冲液F(4 ℃)、TIL冻存液H(4 ℃)、15 mL离心管、细胞冻存管、程序降温盒、移液枪。
将悬浮于培养基内的T细胞团收集于15ml离心管,1000转离心5min,细胞计数,添加TIL冻存液H(浓度为5000000 cell/ml),转移至细胞冻存管内,进行程序降温。
缓冲液F、 TIL细胞扩增培养基B、孔细胞培养板、15mL离心管、水浴锅、3mL巴氏吸管/移液枪。
取15ml离心管,添加8ml缓冲液F待用
从低温环境中取出冻存的细胞,快速置于37 ℃水浴锅中融解,水浴融解过程中,需轻轻摇动冻存管,以确保冻存液在短时间内完全融解。将解冻后的T细胞快速转移至15 mL离心管,使用移液枪轻柔吹打6-8次,1000转离心5 min弃上清。将T细胞沉淀计数,添加合适的 TIL细胞扩增培养基A混匀,每孔添加1.5nl混合液于24孔细胞培养板内观察培养。
FOR LABORATORY RESEARCH USE ONLY. NOT FOR USE IN DIAGNOSTIC PROCEDURES
扫描二维码关注:

联系销售
17749725176
lichangjie@jfkrorganoid.com
建议反馈
17749725176
您的每一条建议声音,我们都认真对待 7*24服务